Um novo catalisador promove uma reação radical assimétrica usando um ligante projetado que pode diferenciar entre grupos alquil muito semelhantes. O processo de aminação estereosseletivo forma alcil aminas altamente enantioenriqueadas, um motivo comum nas moléculas de drogas.
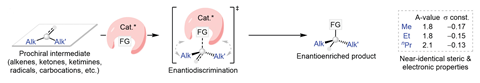
Os radicais são um intermediário comum em muitas transformações sintéticas. Seu único elétron torna essas espécies extremamente reativas, permitindo reações rápidas com entrada mínima de energia. No entanto, para substratos Prochirals – aqueles com três grupos diferentes ligados ao centro de radicais – controlar a enantioselectividade das etapas mecanicistas subsequentes é um desafio quase impossível.
“As principais dificuldades surgem das sutis diferenças estruturais entre os grupos alquil, a tendência de reações de fundo não esterreosseletivas para dominar e as barreiras extremamente baixas de energia que dificultam o controle da enantioselectividade”, explica Xin-yuan Liuque pesquisa química radical na Universidade de Ciência e Tecnologia do Sul na China. Apesar dessas questões, os radicais de di-alquil oscirais ainda são alguns dos intermediários radicais mais amplamente gerados na química sintética, tornando a falta de estereocontrole uma frustração contínua para os químicos orgânicos.
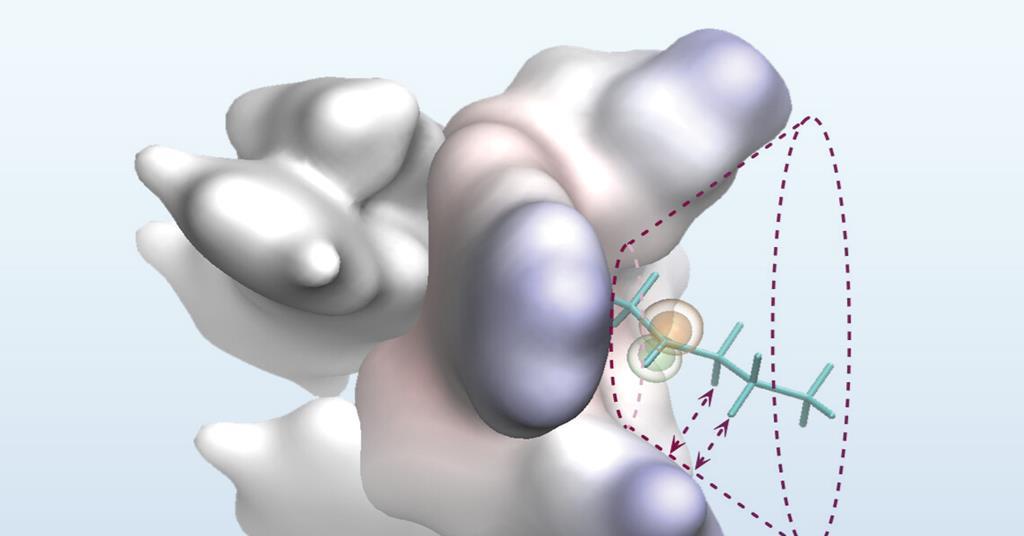
Inspirando-se na capacidade das enzimas de diferenciar entre substituintes alquil semelhantes no local ativo, a equipe de Liu procurou abordar esse problema de seletividade com um complexo de metal-ligante cuidadosamente projetado que incorpora uma bolsa reativa para pré-organizar os substratos problemáticos. Segurando o radical Processal em uma única conformação reativa dentro do orifício em forma de cone, eles levantaram a hipótese de que as etapas de reação subsequentes ocorreriam no mesmo lado da molécula, dando assim um produto de enantiômero único.
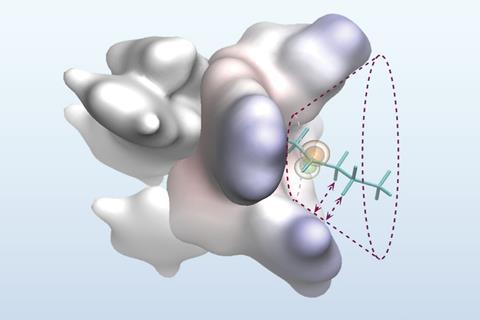
“Durante a reação, partes menores da molécula se encaixam na área interna apertada, enquanto partes maiores são empurradas em direção à região externa mais espaçosa”, explica Liu. ‘Recursos volumosos especiais colocados ao redor da borda do bolso ajudam a orientar a reação, formando interações suaves e não ligadas-como atrações fracas entre átomos de hidrogênio e sistemas de anel próximos’.
A equipe se concentrou no desenvolvimento de uma reação de aminação assimétrica, usando a química de cobre estabelecida para transferir estereosselectivamente um grupo sulfomina para vários radicais di-alquil para formar alquil aminas a-chiral. A reação otimizada, que acomodou processos de radicais térmicos e fotocatalíticos, tolerou uma variedade de grupos funcionais e efetivamente distinguiu entre substituintes de alquil e cicloalquil semelhantes, formando mais de 50 aminas quirais diferentes em um excesso enantiomérico de até 96%.
“O escopo dessa química apresenta principalmente radicais procianos com substituintes metilos, que maximizam a chance de diferenciação estrutural dentro do intermediário radical”, explica Mattia Silvium químico orgânico da Universidade de Nottingham no Reino Unido. ‘No entanto, diferenciação substancial entre um grupo etil e um propil é observado em uma das entradas. Achei essa entrada particularmente interessante e testemunha do notável potencial dessa estratégia assimétrica. ‘ O SILVI ficou impressionado com o rigoroso design do catalisador da equipe e acredita que essa abordagem inspirada em enzimas estimulará outros no campo a desenvolver estratégias semelhantes para diferentes reações.
Enquanto isso, a equipe de Liu já está investigando como essa metodologia pode ser estendida a uma gama mais ampla de transformações, incluindo a formação de ligações carbono -carbono e carbono -hetericômico. “Além disso, estamos trabalhando no desenvolvimento de reações assimétricas que envolvam radicais alquil de alquil substituídos de ensaio não ativado-uma direção particularmente desafiadora, mas promissora, que poderia abrir ainda mais possibilidades na síntese química”, diz Liu.