Por mais de uma década, os cientistas têm crescido organoides – pequenos aglomerados de células que imitam um órgão específico – para servir como modelos biológicos em miniatura. Os organoides do cérebro foram usados para estudar distúrbios neurodesenvolvidos; organoides intestinais, para modelar a doença celíaca; e organoides pulmonares, para investigar SARS-COV-2. Os organoides cardíacos foram enviados ao espaço para testar o efeito da microgravidade no músculo cardíaco. Mas há um pequeno problema – os organoides não podem crescer maiores que uma semente de gergelim.
Ao contrário do tecido vivo no corpo, os organoides não possuem um sistema de vasos sanguíneos que entregue oxigênio e nutrientes a cada célula. Além de cerca de 3 milímetros de diâmetro, um organoide não pode mais se sustentar absorvendo os recursos diretamente de seu ambiente.
“Quando você cultiva organoides para um certo tamanho, eles começam a morrer por dentro porque não conseguem oxigênio e nutrientes no centro”, disse Oscar AbilekMD, PhD, cientista sênior da divisão de cirurgia cardíaca pediátrica.
Mas para um estudar publicado em 5 de junho em CiênciaAbilez e uma equipe de pesquisadores de Medicina de Stanford cresceram organoides cardíacos e fíticos repletos de pequenos vasos sanguíneos, potencialmente permitindo que eles superem o limite atual de tamanho.
A capacidade de cultivar organoides vascularizados supera um grande gargalo no campo, disse Abilez, que é um co-líder do estudo. Os vasos sanguíneos integrados podem permitir que os organoides não apenas cresçam, mas também atingissem um estado mais maduro, tornando -os mais úteis como modelos biológicos.
Huaxiao (Adam) Yang, ex-instrutor do Instituto Cardiovascular de Stanford e agora professor assistente de engenharia biomédica da Universidade do Norte do Texas, liderou o estudo.
Eles também podem ser o próximo passo nas terapias regenerativas, disse Joseph WuMD, PhD, o autor sênior do estudo. Wu é professor de medicina e radiologia, diretor do Instituto Cardiovascular de Stanford, e o Simon H. Stortzer, MD, professor.
Em um estudo clínico separado liderado por Wu, os pesquisadores de Medicina de Stanford estão injetando células cardíacas cultivadas em laboratório, chamadas cardiomiócitos, em pacientes com disfunção cardíaca. “Mas o tecido cardíaco real contém mais do que cardiomiócitos”, disse Wu. “Existem células endoteliais que revestem os vasos sanguíneos, células musculares lisas que envolvem vasos sanguíneos, pericitos que conectam vasos sanguíneos, fibroblastos e outras células”.
No futuro, talvez os organoides cardíacos vascularizados cultivados a partir das células -tronco de um paciente possam ser implantadas cirurgicamente para substituir o tecido perdido ou danificado.
“O pensamento é que, se os organoides tiverem um sistema vascular, eles poderiam se conectar com a vasculatura do hospedeiro, e isso lhes dará uma chance melhor de sobreviver”, disse Abilez.
Teste de receita
Os cientistas cultivam organoides a partir de células -tronco pluripotentes, banhando as células em vários produtos químicos – fatores de crescimento e outras pequenas moléculas – para induzir sua transformação em diferentes tipos de células.
Mas as tentativas de cultivar organoides cardíacos vascularizados produziram níveis inconsistentes dos tipos de células necessários para formar vasos sanguíneos. Outros pesquisadores tentaram uma abordagem de engenharia, células endoteliais de crescimento separadamente ou até redes vascularizadas de bioprintismo 3D, combinando -as com um organoide cardíaco. Mas nenhum alcançou organoides com sistemas realistas de vasos sanguíneos.
“Eles realmente não fazem embarcações ramificadas com passagens”, disse Abilez.
No estudo recentemente publicado, a equipe se propôs a otimizar uma receita química para cultivar organoides cardíacos que pudessem gerar quase todos os tipos de células no coração humano, incluindo células que formam uma rede robusta de vasos sanguíneos.
Os pesquisadores revisaram os métodos estabelecidos para criar três tipos principais de células: cardiomiócitos, células endoteliais e células musculares lisas. Eles combinaram esses métodos em 34 receitas diferentes, ou condições de crescimento – especificando quais fatores de crescimento, quanto e quando adicioná -los – para criar organoides cardíacos contendo todos os três tipos de células.
Eles também modificaram células -tronco para fluorescerem em cores diferentes quando se transformaram nos três tipos de células.
Quando eles testaram as 34 receitas nas células -tronco e permitiram que elas crescessem por cerca de duas semanas, uma em particular – a condição 32 – foi o vencedor claro. Produziu o organoide cardíaco mais colorido.
“Foi bastante óbvio”, disse Abilez. “Escolhemos o que nos deu a maior parte dessas três cores fluorescentes, que correspondem ao maior número de cardiomiócitos, células endoteliais e células musculares lisas”.
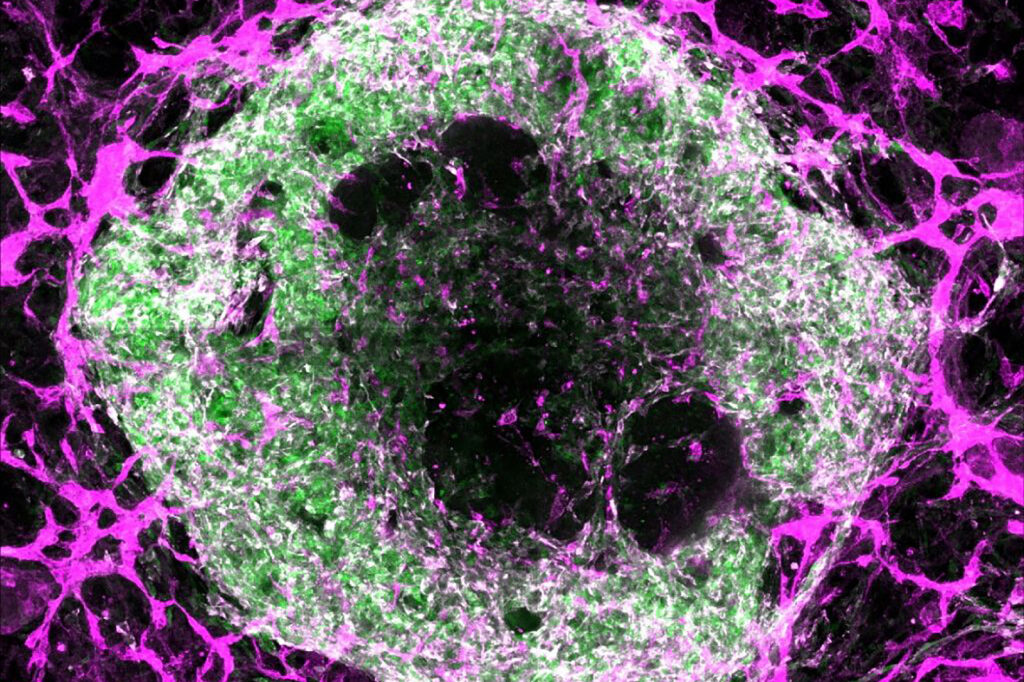
Sob microscopia 3D, os organoides em forma de massa foram organizados com cardiomiócitos e células do músculo liso no interior, juntamente com uma camada externa de células endoteliais que formaram vasos sanguíneos inconfundíveis. Esses pequenos vasos tubulares de ramificação se assemelham aos capilares no coração, que são de 10 a 100 mícrons, sobre a largura de um cabelo, de diâmetro.
Quando os pesquisadores analisaram as outras células nos organoides usando sequenciamento de RNA de célula única, ficaram surpresos ao encontrar quase todos os outros tipos de células do coração. Cada organoide continha 15 a 17 tipos de células diferentes, comparáveis a um coração embrionário de seis semanas de idade, que possui 16 tipos de células. Um coração adulto tem 21 tipos de células.
“Tinha todos esses outros tipos de células encontrados no coração”, disse Abilez. “Isso foi inesperado de uma maneira positiva.”
Modelo de desenvolvimento
A receita vencedora parece aproximar as condições encontradas nos estágios iniciais do desenvolvimento embrionário, quando emergem diferentes tipos de células e os vasos sanguíneos começam a se formar.
Isso sugere que os organoides podem ser valiosos como modelos dos estágios iniciais do desenvolvimento humano, um período difícil de estudar.
“Existe essa caixa preta de desenvolvimento no início da gravidez, quando não é possível, eticamente, testar drogas”, disse Abilez.
Como prova de conceito, os pesquisadores testaram fentanil, um opióide potente e muitas vezes mal utilizado, nos organoides cardíacos vascularizados. Eles descobriram que os organoides expostos a fentanil geravam mais vasos sanguíneos.
“Ainda não sabemos como isso pode se manifestar em um recém -nascido, mas é uma diferença”, disse Abilez.
Outros órgãos
Os pesquisadores também mostraram que sua estratégia de vascularização poderia ser adaptada para criar outros organoides. Ao combinar métodos estabelecidos para diferenciar os principais tipos de células no fígado, eles criaram organoides hepáticos com redes robustas de vasos sanguíneos.
Em estudos futuros, os pesquisadores permitirão que os organoides vascularizados se desenvolvam por mais tempo para ver o quão grande e maduro se tornam. Eles também planejam otimizar ainda mais suas receitas de vascularização para gerar ainda mais tipos de células nos organoides, como células imunes e células sanguíneas, para se assemelhar mais à composição de um coração adulto e do melhor modelo de doenças adultas, disse Wu.
“Eu adoraria poder fazer isso em todos os diferentes tipos organoides”, disse Abilez. “Afinal, quase todos os órgãos do nosso corpo têm um sistema de vasos sanguíneos.”
Para mais informações
Pesquisadores da Universidade do Norte do Texas, Biosciências de Rosebud, Bullseye Biotechnologies e Greenstone Biosciences contribuíram para o trabalho.
O estudo foi apoiado por financiamento do National Institutes of Health, da American Heart Association, do Programa de Pesquisa de Doenças Relacionadas ao Tabaco, Instituto de Medicina Regenerativa da Califórnia, do Instituto Transdisciplinar de Pesquisa de Stanford e da Saúde Infantil, Programa de Iniciativas Transdisciplinares, Stanford Cardiovascular Institute e Stanford Bio-X Program.
Esta história foi publicado originalmente por Stanford Medicine.