UMOs micróbios S invadem o corpo humano, células fagocíticas, como os macrófagos, entram em ação para limpar os intrusos. Essas células estendem as projeções do tipo braço e as envolvem em torno dos micróbios antes de selar-las em vesículas para degradação.
Esse processo de fagocitose é crítico para a eliminação de patógenos, mas os pesquisadores não entendem completamente o destino dos micróbios fagocitados. “Certos fagócitos (podem) extrair antígenos das vesículas que contêm os patógenos, para apresentar esses antígenos às células T”, disse Johan Garaudeum imunologista do Instituto Nacional de Saúde e Pesquisa Médica (INSERM). “Eu queria saber se o conteúdo dessas vesículas também poderia servir o metabolismo de macrófagos”.
Agora, Garaude e sua equipe descobriram que Macrófagos Nutrientes de salvamento de bactérias fagocitadas para apoiar seus requisitos de energia e que essa reciclagem metabólica difere entre as bactérias mortas e vivas.1 Seus resultados, publicados em NaturezaForneça uma compreensão mais profunda das interações-patógenos do hospedeiro e ofereça possíveis alvos terapêuticos contra infecções bacterianas.
As bactérias sequestram nutrientes durante uma infecção, explicou Garaude. “Para compensar (para) essa falta de nutrientes, os macrófagos provavelmente desenvolveram essa capacidade para que possam se alimentar com as bactérias fagocitadas”.
“Este é um estudo muito bom e abrangente”, disse Andrea Wolfum imunologista inato no Centro Médico Cedars-Sinai que não esteve envolvido no estudo. Ela observou: “Evolutivamente, o processo de fagocitose é um método de aquisição de nutrientes”, em que os organismos unicelulares como os amebas dependem. “(Então,) não estou terrivelmente surpreso com isso.”

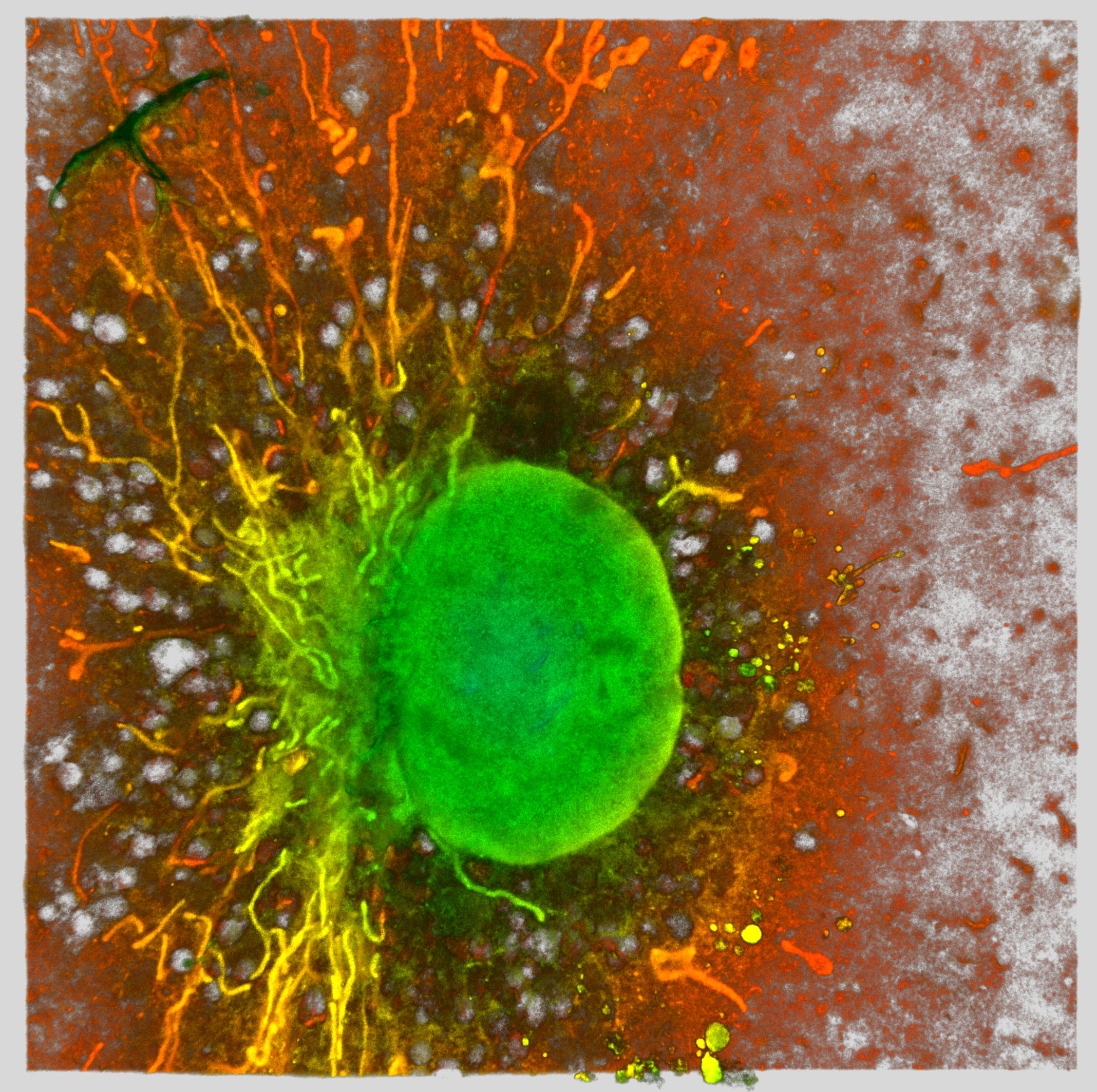
Os macrófagos usam bactérias ingeridas para alimentar a mitocôndria. Usando microscopia de expansão, os pesquisadores capturaram a rede mitocondrial (estruturas de fibrilato) e os núcleos (estrutura redonda verde) de um macrófago murino.
Mónica Fernández Monreal, Universidade de Bordeaux
Garaude e sua equipe começaram tratando macrófagos cultivados com mortos Eles exibiram frio células. Isso resultou em aumento da expressão de genes mitocondriais associados ao transporte de íons. Eles também observaram uma taxa elevada de consumo de oxigênio, sugerindo que a fagocitose de bactérias alimenta a cadeia respiratória mitocondrial.
Para rastrear o destino das bactérias fagocitadas, Garaude e sua equipe expuseram macrófagos cultivados a mortos E. coli que tinham metabólitos marcados com um pesado isótopo de carbono. Usando espectrometria de massa, os pesquisadores rastrearam os átomos de carbono pesado em vários metabólitos de macrófagos, incluindo moléculas antioxidantes e anti-inflamatórias como a glutationa, indicando que as bactérias ingeridas fornecem intermediários metabólicos.
Quando os pesquisadores injetados denominados, mortos E. coli Em camundongos e macrófagos isolados, eles observaram que alguns metabólitos continham carbono pesado, revelando que os fagócitos reciclam metabolicamente bactérias engolidos in vivo.
A equipe levantou a hipótese de que o alvo mecanicista do complexo 1 da rapamicina (mTORC1) via, que ativa a síntese de metabólitos, regulamentaria essa reciclagem de nutrientes derivados de micróbios.2 Para testar o envolvimento do mTORC1, os pesquisadores bloquearam ou ativaram a via em macrófagos. Eles então deixaram essas células engolirem, mataram bactérias e rastrearam o destino dos metabólitos. Eles observaram que a fagocitose por macrófagos com mTORC1 bloqueada resultou em maior catabolismo de nutrientes derivados bacterianos e maiores concentrações de produtos da via da glutationa. A ativação da via nos macrófagos resultou em efeitos opostos, estabelecendo que o mTORC1 regula a reciclagem de nutrientes de micróbios ingeridos.
Garaude e sua equipe investigaram se essa cascata diferisse em bactérias vivas e mortas. As análises metabolômicas revelaram que, em comparação com a fagocitose de bactérias vivas, os macrófagos que engoliram micróbios mortos tiveram aumento da produção de antioxidantes e um metabolito imunomodulador.
“O fato de o manuseio das moléculas ser diferente de acordo com a viabilidade das bactérias … foi realmente bastante surpreendente para nós”, disse Garaude.
A equipe constatou que, diferentemente das bactérias vivas, as bactérias mortas continham 3 ‘, 5’-cíclica monofosfato de adenosina (CAMP) e liberou um subproduto desse metabólito após fagocitose por macrófagos. Por sua vez, isso resultou em uma cascata que inibiu o mTORC1, levando ao aumento das respostas antioxidantes por meio de metabólitos da via da glutationa, eventualmente bloqueando as respostas pró-inflamatórias.
“Não estou surpreso que houvesse diferenças (entre bactérias vivas e mortas)”, disse Wolf. “Gostaria de saber se são realmente diferenças de reconhecimento ou diferenças no tempo”. Ela explicou que as bactérias vivas podem empregar mecanismos para desacelerar os processos que acabarão refletindo o que as bactérias mortas fazem. Ela observou que trabalhos futuros deveriam investigar se os pesquisadores podem explorar as respostas fagocíticas à amortecimento de inflamação.
“(Os resultados) realmente abrem uma nova maneira de ver como o metabolismo poderia ser importante para combater a infecção bacteriana”, disse Garaude. “É uma nova avenida que precisamos explorar um pouco mais como podemos realmente controlar esse fenômeno para combater a infecção bacteriana”.