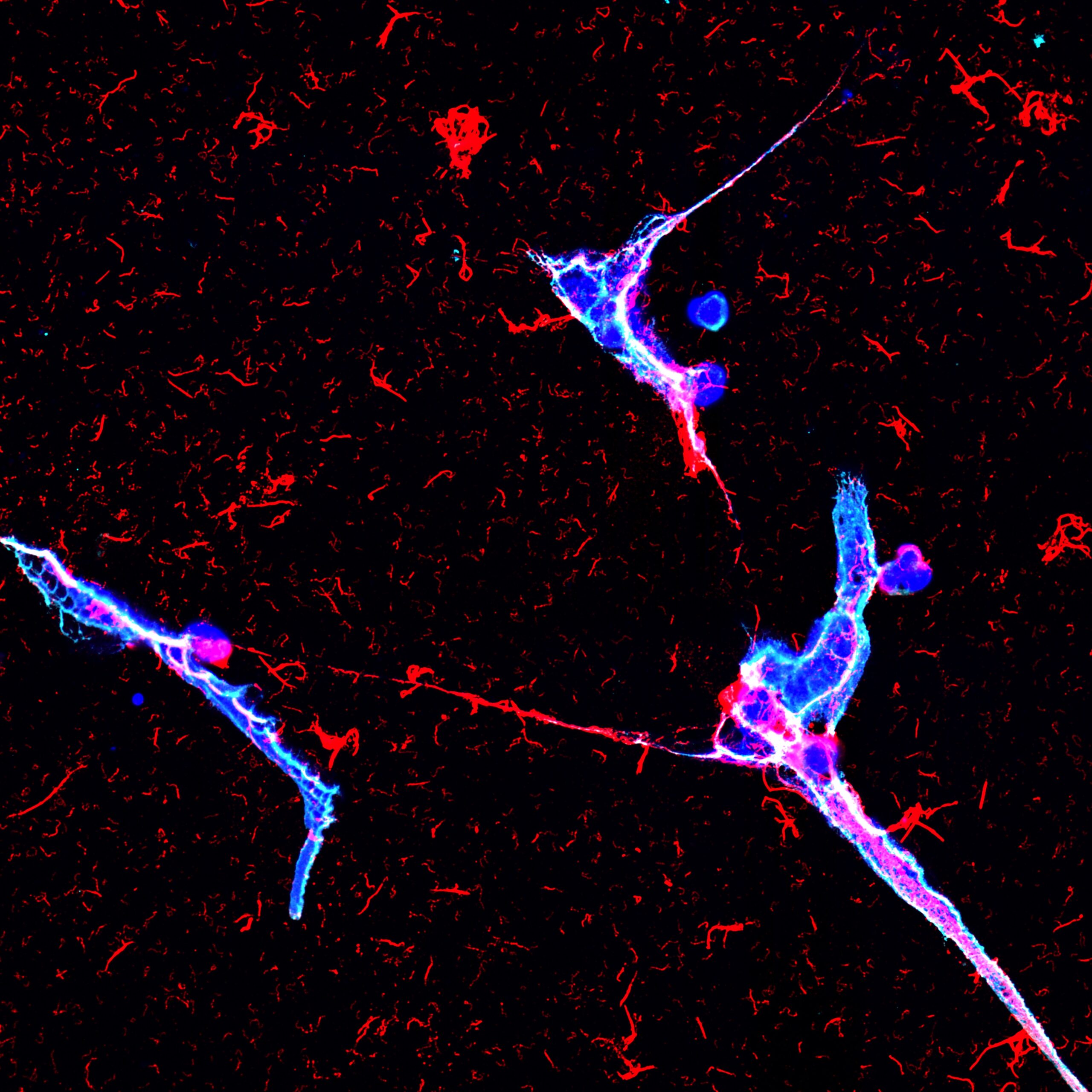
Os neutrófilos no aprisionamento da urina e matam bactérias patogênicas (rosa) liberando teias de DNA (verde) cravejadas com proteínas citotóxicas.
Andy Stewart, laboratório clatworthy
UAs infecções rinárias do trato (ITIS) são uma das infecções bacterianas mais comuns em todo o mundo, afetando centenas de milhões de pessoas a cada ano. Uma flor de bactérias patogênicas na uretra e na bexiga pode causar sintomas reveladores da doença, como dor abdominal, uma sensação de queimação durante a urinação e um aumento do desejo de urinar. Entre 50 e 60 % das mulheres adultas experimentarão Pelo menos uma UTI em sua vida.1 Embora raro, as bactérias podem subir os tubos que transportam a urina para a bexiga – os ureteres – e infectam os rins, levando a uma condição grave chamada pielonefrite, que pode levar à insuficiência renal se não for tratada. Menos de três por cento dos UTIs não complicados progredem para doença renal.2 Isso levanta a questão: como o corpo impede a invasão bacteriana dos rins?
Quando patógenos como bactérias entram no corpo, os neutrófilos são os socorristas do sistema imunológico. Cientistas já mostraram que inibir Recrutamento de neutrófilos resulta em ITIs mais graves em roedores.3 Os neutrófilos matam micróbios envolvendo -os, mas uma enxurrada de relatórios recentes mostra que essas células imunes empregam outra tática: expulsarem seu DNA, criando teias grandes e pegajosas – armadilhas extracelulares de neutrófilos (NETS) – que aprisionam micróbios.4
Agora, pela primeira vez, pesquisadores da Universidade de Cambridge observaram redes na urina humana, oferecendo a oportunidade única de explorar o papel desse mecanismo imunológico no combate a infecções urinárias e prevenção de pielonefrite. “Todos os indivíduos que analisamos, poderíamos encontrar algumas evidências de redes em sua urina, apesar de o paciente não ter nenhuma infecção”, disse Andrew Stewartum nefrologista do Hospital de Addenbrooke Cambridge e co -autor do estudo. Suas descobertas, publicadas em Ciência Medicina Translacionalpoderia levar ao desenvolvimento de terapêuticas aprimoradas para tratar infecções urinárias de complexidades variadas.5
Stewart queria projetar uma maneira não invasiva de diagnosticar doenças renais. Para determinar a extensão dos danos aos órgãos, os profissionais de saúde geralmente precisam realizar uma biópsia. Em vez disso, Stewart queria obter as mesmas informações analisando a urina de um paciente, que contém proteínas originárias de vários tecidos no sistema urinário. “Começamos com (urina de) pessoas saudáveis e descobrimos que ela estava contaminada por algo incomum”, disse ele. Com a ajuda da espectrometria de massa, ele observou um monte de proteínas desconhecidas que diferiam do proteoma conhecido do trato urinário. Stewart e sua equipe levantaram a hipótese de que as proteínas misteriosas estavam interagindo Uromodulina (Umod)uma proteína urinária abundante associada a uma frequência reduzida de ITUs em humanos.6 Eles vasculharam bancos de dados para parceiros conhecidos de ligação de UMOD, compararam as proteínas com seus dados e descobriram que as proteínas em suas amostras eram proteínas de neutrófilos e histonas.

Pela primeira vez, os cientistas mostraram a formação de redes (azul) em urina humana saudável e infectada. Para evitar a infecção do rim, os neutrófilos prendem bactérias (rosa) usando redes de DNA.
Andy Stewart, laboratório clatworthy
Isso contrasta com a suposição amplamente aceita de que os neutrófilos são raros ou ausentes em urina saudável. No entanto, quando Stewart observou a urina humana saudável sob o microscópio, ele não apenas viu neutrófilos, mas descobriu que poderia induzi -los a extrudar seu DNA e formar redes amplas decoradas com umod. “Começamos a procurar algo completamente diferente e encontramos essas teias defensivas de armadilhas de neutrófilos na urina”, disse Stewart. “Quando vimos as redes na urina, dissemos: ‘Uau, isso é alguma coisa.’”
Em seguida, a equipe queria saber o que as redes estavam fazendo na presença de patógenos. Quando induziram uma ITU em camundongos imunocomprometidos, observaram redes revestidas com umod prendendo um grande número de bactérias em suas bexigas. Inibindo quimicamente a netose, o processo de formação de redes, levou a um aumento de bactérias nos rins. Eles também notaram uma abundância de neutrófilos nos rins na presença do inibidor líquido, mas muito poucos deles formaram redes. O bloqueio da letose também diminuiu a agregação de UMOD nos rins, em comparação com camundongos que tinham pielonefrite em condições normais, sugerindo que as redes e o UMOD trabalham coesamente para montar uma resposta antibacteriana. Stewart e sua equipe separaram seus papéis ainda mais e observaram que Nets e UMOD somente eram ineficientes em reduzir a infecção, enquanto uma combinação dos dois foi a mais potente em matar bactérias.
“Se você não tivesse esses mecanismos de defesa, provavelmente teria centenas de infecções do trato urinário por ano”, disse Stewart. Apesar dos sentinelas imunes na urina, alguns indivíduos, especialmente as mulheres, são mais suscetíveis a ITUs e infecções recorrentes. Curiosa, se as variantes genéticas que afetam a letose também influenciaram a tendência de adquirir uma infecção urinária, a equipe se concentrou na enzima peptidil arginina deiminase tipo 4 (PADI4), que é a chave para a ejeção de DNA das células. Usando dados publicados de biobanks, a equipe identificou três polimorfismos de nucleotídeo único no Padi4 Gene que estava associado a um risco reduzido de ITUs, mas um risco aumentado de artrite reumatóide, sugerindo uma troca entre suscetibilidade à infecção e autoimunidade.
A detecção e o tratamento precoce das ITUs é outro fator que é crucial para prevenir a pielonefrite. Um dos testes mais usados para o diagnóstico de ITIs é o teste da vareta de urina. Um teste de vareta de vareta positiva indica que a urina possui neutrófilos e, portanto, patógenos. No entanto, Stewart e sua equipe observaram que o teste se tornou positivo apenas na presença de neutrófilos submetidos a netose, não células intactas, sugerindo que os pacientes que não testam positivos podem estar em maior risco de infecção renal.
“Isso nos dá um novo entendimento do ensaio e como pode ser menos confiável em pacientes que não conseguem montar essa resposta da netose”, disse Glenn Werneburgum urologista da Cleveland Clinic Foundation que não esteve envolvido no estudo.
Stewart está interessado em determinar como os neutrófilos entram na urina, o que os desencadeia a formar redes em diferentes ambientes e os sinais que os fazem parar de liberar seu DNA. “Uma coisa que é consistente é que o tamanho é muito importante. Se um micróbio é realmente grande, como os fungos, as redes tendem a se formar com mais frequência. Se o micróbio for pequeno, o neutrófilo pode tentar comê -lo”, disse ele. “Claramente, o neutrófilo está tomando decisões sobre o que vai fazer.” Stewart pretende entender melhor os fundamentos dessas decisões, para poder intervir quando o processo dá errado. Por outro lado, Stuart especula que as redes excessivas podem causar problemas, como cistite crônica. “A netose tem duas arestas. Aumentar e descer pode ser útil em diferentes situações”, disse ele.