Uma troca estratégica de átomo resolve um problema de seletividade de longa data na síntese de pirazóis complexos e é algo que tem sido na lista de desejos de químicos medicinais por algum tempo. A troca formal de enxofre-nitrogênio alavancou a assimetria no material de partida para instalar regioslectivamente a funcionalidade em um dos dois átomos de nitrogênio relacionados à ressonância. A equipe acredita que essa ampla abordagem conceitual, reimaginando a edição esquelética como uma ferramenta para resolver desafios de seletividade em estágio inicial, pode ser aplicado a outras classes de substrato e sistemas de heteroatom.
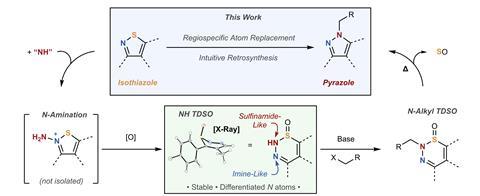
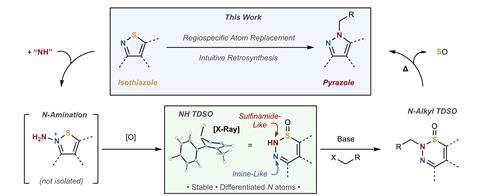
O pirazol, um heterociclo simples de cinco membros contendo dois átomos de nitrogênio adjacente, é um motivo importante em compostos farmacêuticos e agroquímicos. No entanto, estratégias para acessar estruturas substituídas complexas são surpreendentemente limitadas, devido à dificuldade de diferenciar entre os dois heteroátomos do anel. “Os dois nitrogênios no pirazol neutro estão relacionados tautomericamente”, explica o autor co-correspondente Mark Levinum químico orgânico da Universidade de Chicago. “O hidrogênio pode pular para o nitrogênio e, mesmo onde você tem um NH-pirazol assimétrico, os dois nitrogênios podem adotar a posição básica ou aromática reversivelmente, para que ambos sejam nucleofílicos”. Consequentemente, os métodos sintéticos convencionais lutam para atingir um único regioisômer e as misturas resultantes geralmente são desafiadoras para separar, levando ao que os químicos medicinais chamam de ‘problema de alquilação do pirazol’.
Dando um passo para trás desta problemática formação de títulos C – N, Levin e Colaborator Christopher Kelly Em Johnson & Johnson, dividiu o problema em duas partes gerenciáveis: dessembrização e funcionalização. Eles começaram a partir de um material de partida de isotiazol assimétrico, carregando essa assimetria através de uma reação de troca de átomos para controlar a posição da alquilação no produto final. “A idéia aqui é que somos capazes de usar essa substituição de átomos para controlar não apenas os átomos constituintes do anel, mas também os substituintes associados a eles”, explica Levin.
Na primeira etapa, a equipe usou um reagente eletrofílico potente para aminar o isotiazol no nitrogênio. A oxidação subsequente do enxofre adjacente desencadeou um rearranjo em expansão do anel para uma estrutura incomum de seis membros chamada 1,2,3-tiadiazina-s-óxido (TDSO). Esse intermediário inesperadamente estável e isolável cria crucialmente uma distinção química entre os dois átomos de nitrogênio adjacente: o átomo de nitrogênio vizinho que o enxofre é sulfonamida, tornando-o mais ácido, enquanto o nitrogênio distal possui mais caractere de imina.
As condições padrão de alquilação na segunda etapa, portanto, visam seletivamente o nitrogênio ácido da sulfonamida, na maioria dos casos, fornecendo um único produto de alquilação. A reação é então cuidadosamente aquecida para extrudar o monóxido de enxofre, contraindo o anel para formar um pirazol funcionalizado. ‘Um ponto interessante sobre esse processo é que ele é agnóstico ao modo de alquilação, então você não precisa apenas fazer sN2 Química, você pode fazer sNAR, Mitsunobu…. Existem maneiras de aumentar essa química e filosofia ”, diz Kelly.
Indrajeet Sharmaum químico sintético da Universidade de Oklahoma, ficou impressionado com a simplicidade da solução proposta por Levin e Kelly. “Uma grande força deste estudo reside na robustez e praticidade do protocolo – emprega reagentes gerenciáveis e evita a necessidade de condições rigorosas, tornando -o amplamente acessível”, diz ele. No entanto, o escopo limitado do substrato, restrito a grupos baseados em carbono capaz de tolerar as condições de alquilação, pode dificultar seu uso generalizado como uma estratégia de funcionalização em estágio avançado, ele observa.
De forma similar, Richmond Sarpongum químico orgânico da Universidade da Califórnia, Berkeley, acredita que essa é uma abordagem conceitual interessante em relação a um problema sintético de longa data, mas que é necessário mais trabalho para otimizar o método para uso geral. “É um processo de várias etapas e, para essa reação, obter ampla utilidade, a capacidade de conduzir a transformação no mesmo pote usando o mesmo solvente e um único reagente o tornaria mais atraente para os químicos medicinais, que provavelmente o usarão”, diz ele.
Para Levin e Kelly, a reimaginação da estratégia sintética é talvez o impacto mais valioso do trabalho e a equipe agora está explorando como esse conceito poderia se aplicar a outros heterociclos desafiadores. “Até agora, a edição esquelética tem, para o bem ou para o mal, era sinônimo de funcionalização em estágio tardio”, diz Levin. ‘Mas, na verdade, existem outros motivos pelos quais você pode querer fazer edição esquelética. Você pode resolver desafios de seletividade e acho que esse pode ser um aspecto subestimado.
Deixe um comentário